
Synthese von Oligonucleotiden
Automatisierte Synthese von Oligonucleotiden
Eine ausgereifte Synthesechemie und moderne Parallelsynthesizer erlauben heutzutage eine schnelle und effiziente Herstellung von Oligonucleotiden nahezu jeder Sequenz. In einer sogenannten Festphasensynthese wird die gewünschte Oligonucleotidsequenz an einem inerten Trägermaterial aufgebaut und nach Syntheseende von diesem abgespalten. Gegenüber einer Synthese in Lösung hat die Festphasensynthese den großen Vorteil, dass die einzelnen Zwischenstufen nicht mühsam isoliert werden müssen, sondern überschüssige Reagenzien und bestimmte Nebenprodukte durch einfache Wasch- und Filtrationsschritte entfernt werden können.
Synthese
Synthese
Ausgangsmaterialien
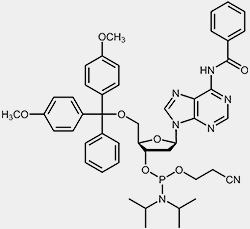
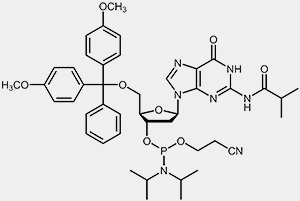
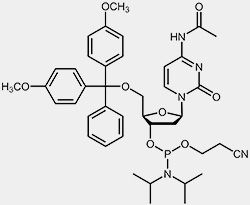
Die wichtigsten Ausgangsmaterialien für die Oligonucleotidsynthese sind die so genannten Nucleosid-Phosphoramidite.
| 2'-desoxy-Adenosin-Phosphoramidit | 2'-desoxy-Guanosin-Phosphoramidit |
|---|---|
 |
 |
| 2'-desoxy-Cytidin-Phosphoramidit | 2'-desoxy-Thymidin-Phosphoramidit |
|---|---|
 |
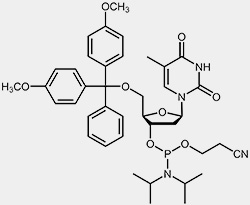 |
Um die 3’-OH befindet sich die reaktive Phosphoramidit-Gruppierung, die 5’-OH ist mit der säurelabilen Dimethoxytrityl-Schutzgruppe (DMT) blockiert, und um zu verhindern, dass die exozyklischen Aminofunktionen von Adenosin, Guanosin und Cytidin während des Syntheseprozesses unerwünschten Nebenreaktionen eingehen können, sind diese mit Acyl-Schutzgruppen blockiert.
Zum Synthesestart ist ein mit dem jeweiligen 3’-Nucleosid des zu synthetisierenden Oligos derivatisiertes Trägermaterial notwendig. Üblicherweise ist das Startnucleosid über basenlabile Linker an Controlled Pore Glass (CPG) oder Polystyrol Beads gekoppelt:
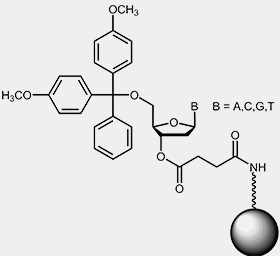 |
Synthesezyklus
Die chemische Synthese von Oligonucleotiden wird von 3’- in 5’-Richtung durchgeführt. Im entscheidenden Kopplungsschritt reagiert ein 3’-Phosphoramidit mit einer freien 5’-Hydroxygruppe:
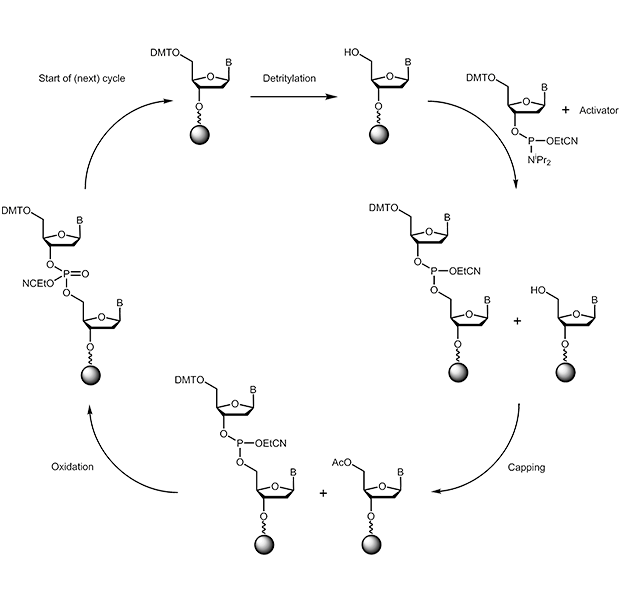 |
a) Tritylabspaltung (Deblocking):
Vom an der festen Phase verankerten Baustein (Startnucleosid oder später die wachsende Oligokette) wird die säurelabile 5’-Dimethoxytrityl-Schutzgruppe abgespalten; es wird so eine freie reaktive Hydroxyfunktion erhalten. Als Abspaltreagenz dient Di- bzw. Trichloressigsäure in Dichlormethan.
b) Kopplung (Coupling):
Die freie 5’-OH-Gruppe kann nun mit einem zugegebenen Phosphoramidit reagieren, es entsteht eine Verknüpfung der beiden Nucleosidbausteine über eine Phosphitbrücke. Das Phosphoramidit muss hierzu zunächst mit einer schwachen Säure (z.B. 1H-Tetrazol) aktiviert werden.
c) Blockieren (Capping):
Da der Kopplungsschritt (wie jede chemische Reaktion) nicht zu 100% vollständig verläuft, muss verhindert werden, dass zurückbleibende freie OH-Gruppen (ca. 1%) im folgenden Synthesezyklus mitreagieren können und so zu unspezifischen Sequenzen führen. Im Capping-Schritt werden sämtliche freien reaktiven Gruppen durch Acetylierung blockiert, sie spielen für die weitere Synthese dann keine Rolle mehr.
d) Oxidation:
Die im Kopplungsschritt entstandene internucleotidische Phosphitgruppierung wird durch Iodlösung zum Phosphat oxidiert.
Ein neuer Synthesezyklus wird wieder mit Schritt a) begonnen. Diese Reaktionen werden wiederholt bis die gewünschte Oligonucleotidsequenz hergestellt ist. Das trägergebundene Oligonucleotid kann entweder mit freier 5’-OH-Gruppe oder mit geschützter 5'-OH-Gruppe (DMT) aus dem Zyklus entlassen werden.
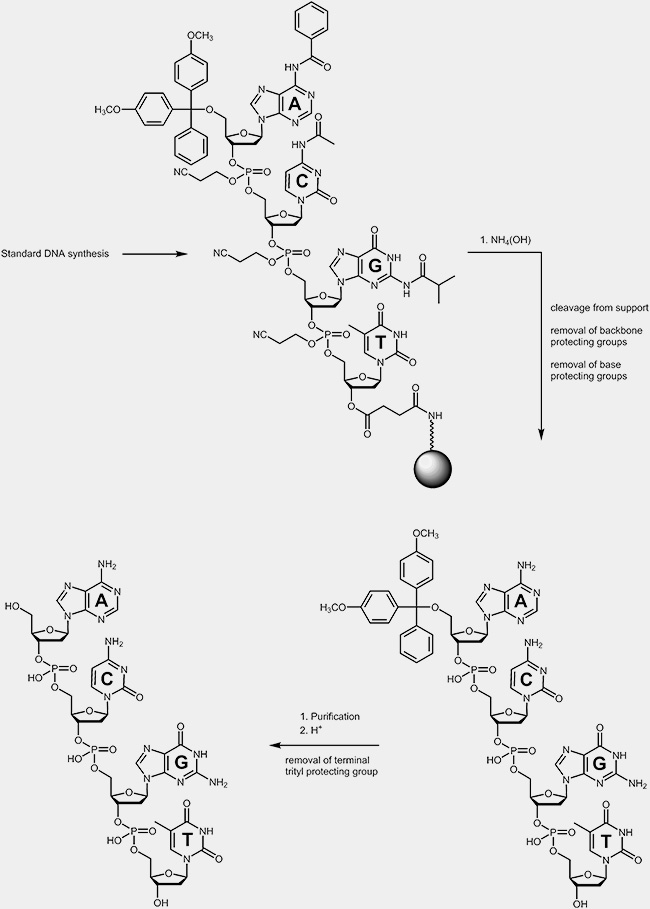
Nach erfolgter Synthese sind folgende weitere Aufarbeitungsschritte notwendig:
a) Abspaltung des Oligonucleotids vom Trägermaterial:
Durch Behandlung des trägergebundenen Oligonucleotids mit konzentrierter Ammoniaklösung wird die Esterbindung zwischen 3’-OH des Oligos und Träger gespalten, das Oligo "schwimmt" in ammoniakalischer Lösung.
b) Abspaltung der Basenschutzgruppen:
Zur Entfernung der Schutzgruppen an den Adenin- Guanin- und Cytidin-Basen und damit zur Freisetzung der exozyklischen Aminofunktionen, wird die ammoniakalische Oligonucleotidlösung bei erhöhter Temperatur erhitzt (üblicherweise zwischen 50°C und 80°C, 1 – 8 Std. je nach Protokoll und verwendeter Schutzgruppen).
Kopplungsausbeute
Schrittweise Kopplungsausbeuten
Unter schrittweisen Kopplungsausbeuten versteht man in der DNA-Synthese die Effizienz, mit der ein neues Phosphoramidit an die wachsende Oligonucleotid-Kette gekoppelt wird, also die Ausbeute über die Schritte eines Reaktionszyklus.
Zu Beginn eines jeden Kopplungszyklus wird zur Freisetzung der reaktiven 5’-OH-Gruppe die Dimethoxytritylschutzgruppe mit Säure abgespalten. Hierbei entsteht ein Dimethoxytrityl-Kation, dessen Menge photometrisch bzw. durch Leitfähigkeitsmessung bestimmt werden kann.
Unter Annahme einer vollständigen Abspaltung der DMT-Gruppe von der Oligonucleotid-Kette kann aus der Menge an DMT-Kation auf die Effizienz des vorhergegangenen Kopplungsschritts geschlossen werden. Diese „Tritylwerte“ und damit die schrittweisen Kopplungsausbeuten sind ein Maß für die Güte des Syntheseverlaufs.
Die durchschnittliche schrittweise Kopplungsausbeute während einer Oligonucleotidsynthese hat einen dramatischen Einfluss auf die theoretisch erhaltbare prozentuale Menge an Zielsequenz:
% Zielsequenz = (durchschnittl. schrittweise Kopplungsausbeute)n (n=Anzahl der Basen)
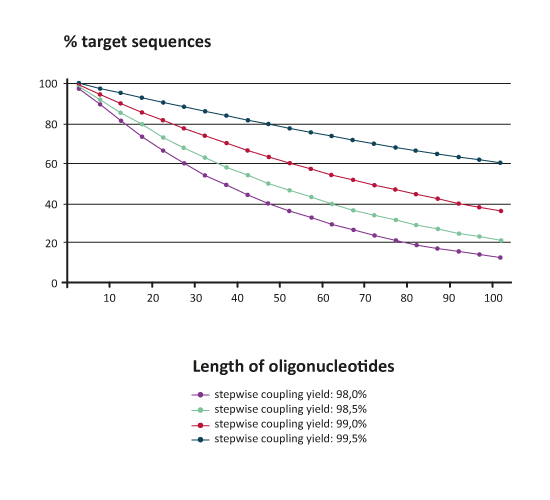 |
Die vorstehende Graphik zeigt, dass z. B. ein 80mer Rohprodukt bei einer sehr guten durchschnittlichen Kopplungsausbeute von 99 % rein rechnerisch deutlich unter 50% Zielsequenz enthalten muss; der Rest besteht aus kürzeren n-x Produkten. Je nach Experiment muss daher gut abgewogen werden, mit welchem Verfahren das Roholigonucleotid weiter aufgereinigt werden soll.
Abspaltungen
Abspaltung
Während des Entschützungsprozesses erfolgt die Abtrennung der Oligonucleotide von der Festphase, auf der die Synthese stattfand, und die Entfernung der Basenschutzgruppen und der Schutzgruppen am Phosphatrückgrat. Diese verhinderten unerwünschte Nebenreaktion während der Synthese. Die terminale Tritylschutzgruppe wird in den meisten Fällen nach der Reinigung der Oligonucleotide entfernt.
 |

